Чрескожное остеоинтегрируемое протезирование конечностей у собак и кошек после частичной ампутации на основании серии клинических случаев
Горшков С.С.1, Уланова Н.В.1, Мануйлова В.В.1, Твердохлебов С.И.2
1Ветеринарная клиника «Бэст», г. Новосибирск;
2Национальный исследовательский Томский политехнический университет, г. Томск.
«Между медициной и ветеринарией не существует разделительной линии — и она не должна возникнуть когда-либо» (Рудольф Вирхов, 1900).
Сокращения:
ЧОП — чрезкожное остеоинтегрируемое протезирование;
КП — протезы — культеприемные протезы или протезы с культеприемной гильзой;
ОСХ — органосохранная хирургия (син. органосохраняющие оперативные вмешательства (англ. Limb salvaging surgery (LSS);
ПКГ — Протезы с культеприемной гильзой (англ. Stump socket prostheses (SSP));
КТ — компьютерная томография
УЗИ — ультразвуковое исследование сердца;
ТБС — тазобедренный сустав.
Abstract
В данной статье рассмотрена методология чрескожного остеоинтегрируемого протезирования (ЧОП) конечностей у животных после перенесенной ампутации, представлен опыт использования протезов SerGoFIX™ — вживляемых внутрикостных индивидуальных имплантатов разработанных на базе клиники «Бэст». Метод внутрикостного протезирования, основанный на принципе остеоинтеграции, который был предложен проф. Per-Ingvar Brånemark, является одним из перспективных направлений в современной реконструктивной хирургии и на сегодняшний день является «золотым стандартом» дентальной имплантации с 1970-х годов. Дальнейшее развитие методологии нашло свое применение в ортопедии, онкохирургии сформировавшись в отдельное направление - чрескожное остеоинтегрируемое протезирование конечностей после перенесенной ампутации.
В гуманной медицине данный подход позволяет достичь более высоких показателей функциональной активности пациентов, а также повысить качество жизни по сравнению с традиционной технологией, с использованием протезов с культеприемной гильзой. Для животных данный метод может быть альтернативой полной ампутации при травматических, неопластических поражениях дистальных сегментов конечностей, а также при врожденных деформациях, с достижением функциональных результатов в виде полноценной опороспособности в сравнении со стандартной калечащей процедурой ампутации.
Представлены отдаленные результаты наблюдений наиболее длительные из которых составляют 7, 13 и 14 месяцев на момент написания данной работы, а также рассмотрены ограничения метода и осложнения. Общее количество прооперированных пациентов на момент написания работы составляет n=9 с имплантацией 13 протезов. Оценка остеоинтеграции была выполнена с помощью клинических и рентгенологических методов оценки. Остеоинтеграция с восстановлением полноценной опороспособности была достигнута у 7 пациентов, что составляет 77.8% от общего числа прооперированных животных.
Актуальность
В экономически развитых странах основной причиной утраты конечности являются хронические сосудистые заболевания, травмы, онкологические заболевания, инфекции, артериальная эмболия [1]. Так, в США в 2008 г. было зарегистрировано приблизительно 1,7 миллионов человек с утратой конечности. Как известно, тотальная или частичная ампутация конечности является калечащей операцией как в гуманной, так и в ветеринарной медицине. Наиболее часто ампутация применяется при тяжелых травматических повреждениях конечностей, некоторых неопластических поражениях опорно-двигательного аппарата, а также в случае определенных аномалии развития конечности у собак и кошек [3, 4, 5]. По статистике США более 120000 ампутаций выполняется ежегодно в гуманной медицине (Marks L.J., Michael J.W., BMJ. 2001). По животным, данной статистики не имеется, однако ежегодно фиксируется около 6000-8000 случаев остеосаркомы у собак (Dernell, Straw, Withrow, 2001). К сожалению, тотальная (полная) ампутация пораженной конечности, часто является стандартом лечения при неопластических поражениях апендикулярного скелета у людей и собак [2]. Однако в последние 20 лет в гуманной онкохирургии, онкоортопедии и в последние 10 лет в ветеринарной медицине, все чаще отдается предпочтение органосохранным методам [2, 5].
В ветеринарной хирургии, показания к полной ампутации конечности включают: тяжелое травматическое повреждение конечности, ишемический некроз, хроническая некупируемая инфекция (остеомиелит), резистентный к консервативному лечению артрит, паралич (авульсионные повреждения корешков спинного мозга), врожденные деформации и неоплазии [2, 4, 5].
Ампутация представляет собой простую, не дорогую процедуру, не требующую специального оборудования и имеющую предсказуемый результат в большинстве случаев. Однако в ряде случаев, ампутация может быть не самым оптимальным вариантом лечения для пациента. Например, по ряду данных у гигантских пород собак после ампутации, функция конечности может быть не удовлетворительной [5]. Собаки с ампутацией грудной конечности труднее удерживают равновесие, значительно чаще падают в сравнении с мелкими и карликовыми породами собак перенесших подобную хирургию [6]. Эти данные были подтверждены в недавнем докладе, а также одним из выводов являлось, что более существенные изменения походки наблюдаются у собак после ампутации грудной конечности, чем тазовой [7]. Данный вывод представляется закономерным, на основании известных данных о нагружаемости грудных (60% нагрузки) и тазовых конечностей (40%) у собак [22].
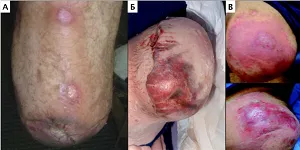
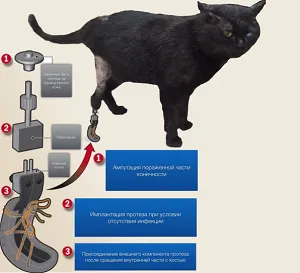
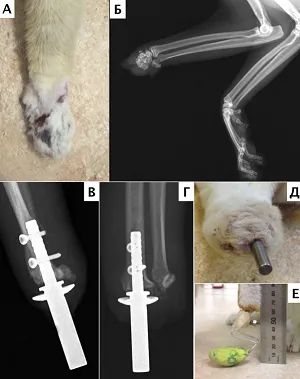
 Уже более 600 лет и до сегодняшнего дня, стандартным методом реабилитации пациентов после перенесенной ампутации в гуманной медицине является использование протезов с культеприёмной гильзой (ПКГ) [8] (Рис. 1). Стандартный постоянный протез, как правило, имеет модульную структуру и состоит из протезной стопы, культеприемной гильзы, адаптеров, соединительных элементов и одевается на культю конечности как «стакан». Данные протезы, применяются после частичной ампутации конечности, широко распространены в гуманной медицине, а также являются коммерчески доступными и для животных [2] (Рис. 2). На сегодняшний день, имеются единичные сообщения о применении ПКГ у собак, хотя первые доклады появились еще в 1906 г. и пионером в данной области является Hobday [11] (Рис. 3). Однако по данным гуманной медицины, метод обладает рядом существенных недостатков, среди которых выделяют дискомфорт (44%), боль (62%), опрелости и натирание кожных покровов (72%), инфекции и некроз тканей, в частности в период адаптации ношения ПКГ [2] (Рис.4).
Уже более 600 лет и до сегодняшнего дня, стандартным методом реабилитации пациентов после перенесенной ампутации в гуманной медицине является использование протезов с культеприёмной гильзой (ПКГ) [8] (Рис. 1). Стандартный постоянный протез, как правило, имеет модульную структуру и состоит из протезной стопы, культеприемной гильзы, адаптеров, соединительных элементов и одевается на культю конечности как «стакан». Данные протезы, применяются после частичной ампутации конечности, широко распространены в гуманной медицине, а также являются коммерчески доступными и для животных [2] (Рис. 2). На сегодняшний день, имеются единичные сообщения о применении ПКГ у собак, хотя первые доклады появились еще в 1906 г. и пионером в данной области является Hobday [11] (Рис. 3). Однако по данным гуманной медицины, метод обладает рядом существенных недостатков, среди которых выделяют дискомфорт (44%), боль (62%), опрелости и натирание кожных покровов (72%), инфекции и некроз тканей, в частности в период адаптации ношения ПКГ [2] (Рис.4).
Осложнения, связанные с протезированием ПКГ у животных, аналогичны осложнениям в гуманной медицине [2]. Касаемо использования ПКГ у мелких домашних животных, по ряду сообщений, это не приводит к удовлетворительным результатам в плане восстановления функциональной опороспособности и связано как с не достаточным качеством изготовления протезов и как результат его механическая несостоятельность, так и с не надежным креплением к культе конечности у собак [2, 16]. По другим данным при использовании ПКГ у собак, осложнения в отдаленном периоде имели пациенты после перенесенной ампутации преимущественно на грудную конечность, которые включали: значительный вес внешнего протеза (у собак менее 10 кг), поверхностная инфекция, пролежни, некроз мягких тканей от избыточного давления, болевой синдром [12, 14]. Таким образом, на сегодняшний день в гуманной и ветеринарной медицине проблема протезирования после частичной ампутации конечностей окончательно не решена.
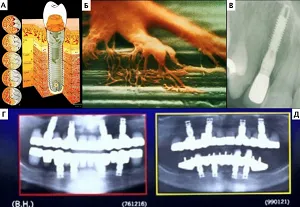
В 1970 профессор Бранемарк (Per-Ingvar Brånemark) в серии экспериментов, а также далее в клинической практике дентальной имплантации доказал, что титан способен образовывать прочный контакт с окружающей его костной тканью, за счет формирования стойкой пассивной плёнки из оксида титана (TiO2) на поверхности металла [13] (Рис. 5). Данный метод протезирования был внедрён в клиническую практику в области ортодонтии в середине 1970-х гг. и к настоящему времени является «золотым стандартом» в стоматологии, а именно в протезирования зубов [13]. Феномен прочного структурного и функционального соединения имплантата с окружающими костными тканями был назван остеоинтеграцией (Рис. 6). Открытие явления остеоинтеграции имплантатов, явилось значительным научным прорывом в стоматологии за последующие десятилетия. С момента успешного внедрения методики внутрикостного протезирования в стоматологии появляется всё больше данных о возможности расширения показаний и спектра клинических состояний для данного подхода в медицине и прежде всего, в таких областях как онкохирургия, ортопедия и реконструктивная хирургия (Рис. 7).
 Одной из первых точек приложения внутрикостного имплантата для протезирования в клинической практике, стало протезирование нижней конечности в гуманной медицине и на сегодняшний день данный метод имеет название остеоинтегрируемое протезирование (прим. в данной работе в дальнейшем будет использован термин ЧОП — чрескожное остеоинтегрируемое протезирование; англ. Percutaneous osseointegrated prostheses) (Рис.8).
Одной из первых точек приложения внутрикостного имплантата для протезирования в клинической практике, стало протезирование нижней конечности в гуманной медицине и на сегодняшний день данный метод имеет название остеоинтегрируемое протезирование (прим. в данной работе в дальнейшем будет использован термин ЧОП — чрескожное остеоинтегрируемое протезирование; англ. Percutaneous osseointegrated prostheses) (Рис.8).
Метод ЧОП, основанный на принципе остеоинтеграции, является одним из перспективных направлений в современной реконструктивной хирургии. На сегодняшний день метод позволяет избежать множество недостатков традиционного культеприемного протеза, а именно: отсутствие культеприемной гильзы — протез является «естественным» продолжением конечности; пациент имеет «тактильную чувствительность протезом» (остеоперцепция), метод позволяет выполнять более значимые и интенсивные нагрузки протезированной конечностью в сравнении с ПКГ. В отличие от ПКГ, механическая нагрузка передается от внешнего (наружнего) экзопротеза к кости через внутрикостный эндопротез. После ЧОП конечностей после перенесенной ампутации на основании множества сообщений из гуманной медицины отмечается улучшение функции и качества жизни пациентов в абсолютном большинстве случаев (Jönsson S., CaineWinterberger K., Brånemark R: Orthot. Int. 2014; 35:190-200).
Чрескожные остеоинтегрируемые протезы используются в гуманной медицине при травматических и онкологических поражениях конечностей последние 10-15 лет, однако лишь в некоторых странах (Швеция, Австралия, Нидерланды) в нескольких центрах и все еще не вошли в широкую клиническую практику ортопедии и онкохирургии в мире. Связано это с общей длительной реабилитаций пациентов (в гуманной медицине традиционно применяется двухэтапное протезирование, общий процесс которого может занимать от 8 мес. до 2-х лет с привлечением ортопеда, протезиста и врача-реабилитолога) и, соответственно, финансовой составляющей, а также с потенциальной возможностью развития осложнений. Определенная консервативность и скепсис в среде врачей-ортопедов и онкохирургов связанная с предполагаемой высокой частотой развития осложнений, также является определенным камнем предкновения и причиной «медленного» внедрения метода в широкую клиническую практику.
Общие осложнения, связанные с ЧОП включают: раздражение кожи, инфекцию, болевой синдром, разрыв кожи (перипротезная область), несостоятельность внутрикостного, наружнего компонента протеза, непродолжительную долговечность имплантата [2, 16].
На сегодняшний день имеется лишь несколько публикаций о применении ЧОП конечностей у животных в клинической практике [2, 16]. По данным литературы и обзора в системе PubMed, наибольшее количество пациентов, прошедших процедуру ЧОП, было представлено в работе N. Fitzpatriсk с описанием 4-х клинических случаев [2]. Однако из них имеется лишь два отдаленных результата, превышающих более 12 месяцев в связи с неопластическим характером поражения в исследуемой группе.
Относительные противопоказания к ампутации конечности у животных могут включать: дегенеративные поражения контралатеральных конечностей (тяжелый остеоартрит), избыточную массу тела (ожирение), неврологический дефицит (дегенеративный пояснично-крестцовый стеноз), а также другие патологии, которые могут повлиять на восстановление функции опороспособности.
Таким образом, данные пациенты, требуют альтернативного подхода в лечении с возможностью сохранения функции конечности. Наиболее перспективным методом, соответствующим данной концепции и позволяющим сохранить опороспособность, по нашему мнению, представляется чрескожное остеоинтегрируемое протезирование (ЧОП) конечностей.
Дизайн работы
Ретроспективный анализ серии клинических случаев.
Цели и задачи
Сообщить о клиническом опыте и возможности применения метода ЧОП конечностей у собак и кошек после перенесенной частичной ампутации (экзартикуляции) с имплантацией индивидуально изготовленных имплантатов SerGoFIX в качестве органосохранной процедуры на примере серии клинических случаев.
Материалы и методы
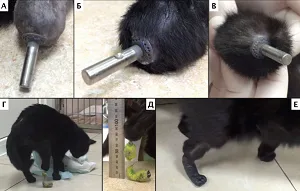
 В период с января 2016 по февраль 2017 года (наблюдение — по апрель 2017 (на момент написания статьи)) процедура ЧОП с имплантацией протезов SerGoFIX была выполнена собакам (n=2) и кошкам (n=7), имеющим травматические (n=7 холодовая травма, отморожение; n=1 посттравматический остеомиелит) и неопластические (n=1 синовиальная саркома запястья у собаки) поражения дистальной части грудных и тазовых конечностей. Средний возраст пациентов составлял 3-5 лет (1 собака — 10 лет). Суммарное количество установленных имплантатов на момент написания работы n=13 у 9-ти пациентов.
В период с января 2016 по февраль 2017 года (наблюдение — по апрель 2017 (на момент написания статьи)) процедура ЧОП с имплантацией протезов SerGoFIX была выполнена собакам (n=2) и кошкам (n=7), имеющим травматические (n=7 холодовая травма, отморожение; n=1 посттравматический остеомиелит) и неопластические (n=1 синовиальная саркома запястья у собаки) поражения дистальной части грудных и тазовых конечностей. Средний возраст пациентов составлял 3-5 лет (1 собака — 10 лет). Суммарное количество установленных имплантатов на момент написания работы n=13 у 9-ти пациентов.
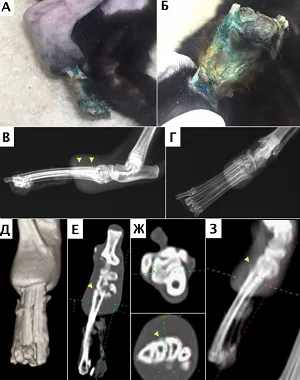
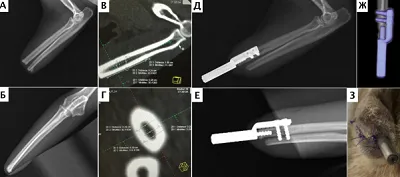
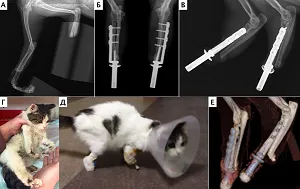
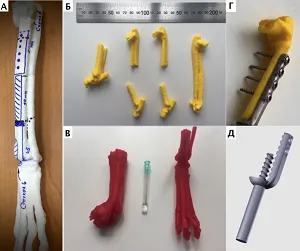
Во всех случаях (n=9) было выполнено общее физикальное обследование, а также пальпация и осмотр области имплантации культи конечности на наличие / отсутствие повреждений. Предоперационно было выполнено (n=9): рентгенологическое исследование в 2-х ортогональных плоскостях, клинический и биохимический анализы крови, УЗИ сердца, КТ грудных / тазовых конечностей (области интереса), а также КТ онкопоиск в одном случае неопластического поражения дистального сегмента предплечья. По данным КТ во всех случаях выполнялось предоперационное планирование, оценка структуры костной ткани и проведены замеры поперечника кости, а также ширины сегмента области имплантации (дистальная часть предплечья, дистальная часть голени, таранная кость). У четырех пациентов (n=4) на основании данных КТ предоперационно было выполнено прототипирование с дальнейшим созданием пластиковых 3D моделей сегментов конечностей для отработки и оценки позиционирования имплантатов (Рис. 9).
Используемые имплантаты разработаны и изготовлены индивидуально для каждого пациента, в связи с чем имеется некоторая вариабельность по строению, форме, конструкции и особенностям микроструктуры поверхности имплантатов.
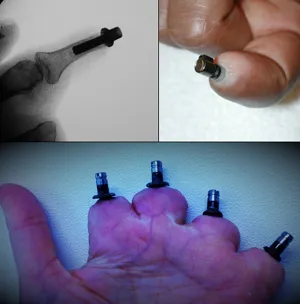
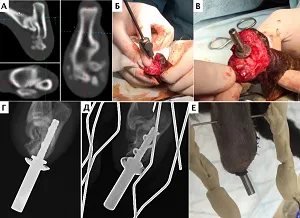
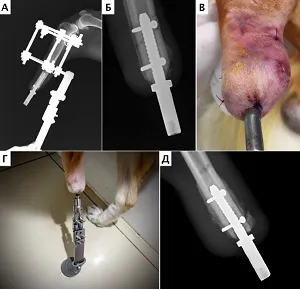
 Все имплантаты SerGoFIX имеют внутрикостный и наружный компонент (эндо и экзопротез). Серия имплантатов (n=6) была изготовлена на основании данных КТ по параметрической цифровой модели с использованием аддитивных технологий (3D печать) методом прямого лазерного спекания металлов (Direct Metal Laser Sintering, DMLS; EOS M 290) с использованием материала Ti-6Al−4V (Рис. 10). В основе технологии DMLS лежит принцип послойного выращивания твердотельного объекта по цифровой 3D-модели, которая предварительно проектируется по результатам КТ. Другая серия имплантатов (n=3) была изготовлена токарно-фрезерным методом (ЧПУ СТХ 310 ecoline V3). Во всех случаях (n=13) было выполнено модифицирование естественной макро и микроструктруры имплантатов с созданием 2-х уровней биопокрытия с формированием пористого компонента, что позволяет усилить «сцепление» имплантата с костной тканью, повышая вероятность остеоинтеграции. Стоит отметить, что для достижения остеоинтеграции и оптимальных отдаленных результатов, критичным является соблюдение таких параметров как: материал имплантата, его конструктивные особенности (форма, резьба, режущая кромка), а также создание «биологической» поверхности имплантата, путем его модификации. На сегодняшний день методика ЧОП протезами SerGoFIX является собственной разработкой авторов данной работы и проходит процедуру международного патентования.
Все имплантаты SerGoFIX имеют внутрикостный и наружный компонент (эндо и экзопротез). Серия имплантатов (n=6) была изготовлена на основании данных КТ по параметрической цифровой модели с использованием аддитивных технологий (3D печать) методом прямого лазерного спекания металлов (Direct Metal Laser Sintering, DMLS; EOS M 290) с использованием материала Ti-6Al−4V (Рис. 10). В основе технологии DMLS лежит принцип послойного выращивания твердотельного объекта по цифровой 3D-модели, которая предварительно проектируется по результатам КТ. Другая серия имплантатов (n=3) была изготовлена токарно-фрезерным методом (ЧПУ СТХ 310 ecoline V3). Во всех случаях (n=13) было выполнено модифицирование естественной макро и микроструктруры имплантатов с созданием 2-х уровней биопокрытия с формированием пористого компонента, что позволяет усилить «сцепление» имплантата с костной тканью, повышая вероятность остеоинтеграции. Стоит отметить, что для достижения остеоинтеграции и оптимальных отдаленных результатов, критичным является соблюдение таких параметров как: материал имплантата, его конструктивные особенности (форма, резьба, режущая кромка), а также создание «биологической» поверхности имплантата, путем его модификации. На сегодняшний день методика ЧОП протезами SerGoFIX является собственной разработкой авторов данной работы и проходит процедуру международного патентования.
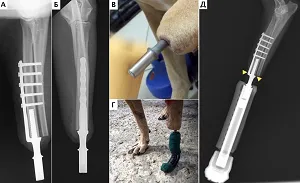
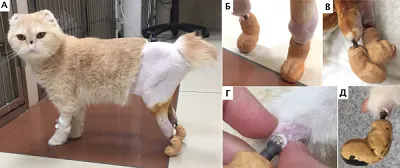
Экзопротезы были индивидуально разработаны на основании мастер-модели и выполнены (3d печать) из полиамида методом селективного лазерного спекания (Selective Laser Sintering) с дальнейшим креплением к трансдермальной ножке эндопротеза (внутрикостного протеза) через индивидуальный кондуктор. Последующие модели экзопротезов в своем составе имеют силиконовый композит как составную часть экзопротеза, позволяющую выполнять смену части протеза по мере его изнашивания (Рис. 11).
Процедура ЧОП включала в себя одноэтапную (одномоментную) ампутацию (экзартикуляцию) с дальнейшей имплантацией протезов (n=3) в случаях отсутствия инфекционных поражений кожного покрова, костной ткани (некроз, остеомиелит), а также двухэтапную ампутацию / экзартикуляцию (n=6), с имплантацией протеза через 3-4 недели в случае наличия инфекционных поражений или каких-либо повреждений (Рис. 12). По уровню резекции пораженного сегмента выполняли: экзартикуляцию на уровне лучезапястного сустава (n=3), заплюсневоголенного сустава (n=1), проксимального голенотаранного сустава (n=3), ампутацию на уровне нижней трети диафизарного сегмента предплечья (n=1) с отступом 3,5 см от видимой границы опухоли, ампутацию на уровне дистального сегмента голени (n=1).
Оценка результатов
Послеоперационный рентгенологический контроль выполнялся в соответствии с разработанным авторами данной работы протоколом наблюдений за пациентами после ЧОП и был выполнен в день операции, далее через 1/ 4/ 6/ 10/ 12 месяцев (далее оценка через каждые 6 мес. в соответствии с протоколом), а также при необходимости в случае развития осложнений.
Оценка кожной интеграции выполнялась клинически на основании физикальных методов обследования. Оценивались такие параметры трансдермального контакта протеза как: болевой синдром при пальпации, гиперемия, наличие отделяемого. Кожная интеграция при нормальном восстановительном периоде достигалась в среднем через 4 недели. Купирование болевого синдрома при пальпаторной оценке нивелировался в среднем через 6-7 недель.
Наиболее важной оценкой для прогнозирования долгосрочных результатов является оценка остеоинтеграции имплантатов. На сегодняшний день выделяют три типа интеграции: остеоинтерграция, фиброостеоинтеграция и псевдоартроз [13, 15]. Первые два типа интеграции являются необходимыми для длительного и стабильного расположения имплантата в кости и позволяют говорить об адекватной фиксации имплантата с получением предсказуемо хороших отдаленных результатов. При этом решающим фактором для направленной интеграции является функциональная нагрузка и ее степень. Третий вариант является нормальным для соединительной ткани, однако для собственно костной ткани – это неадекватный ответ на введение имплантата, который свидетельствует об отторжении с дальнейшим развитием несостоятельности (дестабилизации) имплантата. О нормальной интеграции имплантатов свидетельствуют только наличие остеоинтеграции и фиброостеоинтеграции, для развития которых необходимы: точное соответствие имплантационного ложа, хорошая первичная фиксация имплантата, атравматизм операции, биологическая совместимость имплантата, тщательный послеоперационный мониторинг пациента.
Достоверная, прямая оценка остеинтеграции базируется на данных гистологического исследования, что в клинической практике не представляется возможным. Однако известны несколько методов косвенной оценки степени остеоинтеграции и стабильности имплантатов [13]: клинический метод, рентгенологические методы оценки (денситометрическая оценка плотности костной ткани), торк-тест с помощью динамометрического ключа, периотестометрия, частотно- или магнитно-резонансный анализ [18].
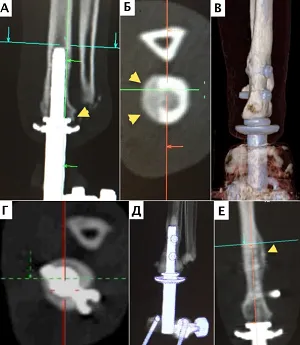
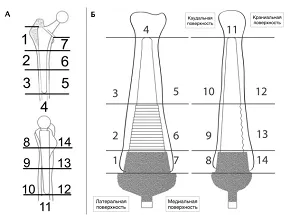 Для объективной оценки реакции костной ткани на протез, степени остеолиза, миграции имплантатов выделяют зоны проекции эндопротеза на основании данных рентгенограмм. Наибольшее распространение получила классификации Груэна (Gruen et al., 1979) для описания изменений вокруг ножки эндопротеза (перипротезной области) в 14-ти зонах [20] (Рис. 13). Данная классификация может быть использована и для оценки остеоинтеграции после ЧОП [19]. Согласно классической методике оценки по Gruen выполняется оценка состояния кости по зонам с целью выявить: наличие линий рентгеновского просветления, наличие зон остеолиза, утолщение или истончение кортикальной кости, изменение трабекулярной кости.
Для объективной оценки реакции костной ткани на протез, степени остеолиза, миграции имплантатов выделяют зоны проекции эндопротеза на основании данных рентгенограмм. Наибольшее распространение получила классификации Груэна (Gruen et al., 1979) для описания изменений вокруг ножки эндопротеза (перипротезной области) в 14-ти зонах [20] (Рис. 13). Данная классификация может быть использована и для оценки остеоинтеграции после ЧОП [19]. Согласно классической методике оценки по Gruen выполняется оценка состояния кости по зонам с целью выявить: наличие линий рентгеновского просветления, наличие зон остеолиза, утолщение или истончение кортикальной кости, изменение трабекулярной кости.
Рентгенологическими проявлениями нестабильности ножки являются: миграция имплантата, широкая зона остеолиза вокруг ножки, образование периостальной и эндостальной костной реакции вокруг верхушки ножки эндопротеза. Также имплантацию считают неудачной в случаях значительной потери уровня краевой кости, разрежении вокруг имплантата на рентгенограмме, при подвижности имплантата, боли, дискомфорте при условии клинического отсутствия функциональной опоры на конечность.
Во всех случаях в данной работе выполнялась рентгенологическая и клиническая оценка стабильности имплантатов в краткосрочный и долгосрочный послеоперационный период.
У пациентов в отдаленный послеоперационный период (более 6 мес.) (n=4) для оценки остеоинтеграции выполняли КТ - денситометрию. Вычисленные коэффициенты ослабления рентгеновского излучения выражаются в относительных величинах, так называемых единицах Хаунсфилда (Hounsfield units, HU; денситометрических показателей, англ. HU). КТ является особенно приоритетным методом на этапе диагностики, предоперационного планирования, а также является более точным для количественной оценки степени остеоинтеграции путем выполнения денситометрии [18].
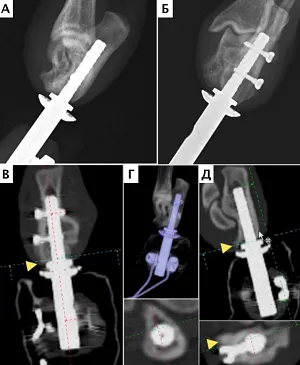
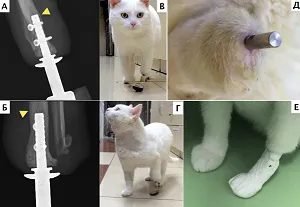
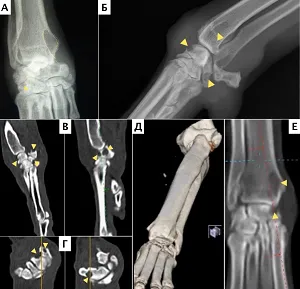
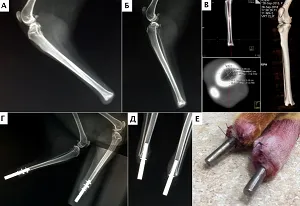
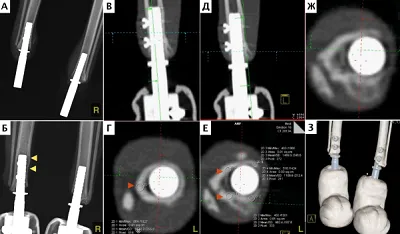
В 2-х случаях отдаленного наблюдения была констатирована стабильность имплантатов с достижением остеоинтеграции через 13 и 14 мес. с момента их имплантации (Рис. 14-20);
в 4-х случаях через 3, 4, 6 и 7 месяцев (Рис. 22-29); в одном случае после ревизионного эндопротезирования через 2 месяца признаков нестабильности также не отмечено. Стоит отметить, что в одном случае у пациента после одномоментной процедуры ЧОП двух тазовых конечностей (2 протеза) на уровне дистальных сегментов голени через 7 месяцев наблюдались рентгенологические признаки стрессового перипротезного (адаптационного) ремоделирования кости («стресс-шилдинг» синдром, stress-shielding) с краевой резорбцией медиального кортикального слоя дистального сегмента большеберцовой кости без клинических признаков снижения опороспособности и без болевого синдрома (Рис. 26).
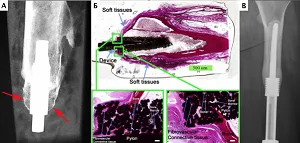
Остеоинтеграция не была достигнута в следующих случаях: ранняя сверхнагрузка на имплантат (n=1) через 14 дней после имплантации, что привело к его дестабилизации и ревизии; глубокая перипротезная инфекция (n=1) с последующим развитием остеомиелита, несостоятельность костной ткани (перелом) с дальнейшей ревизией протеза. Данному пациенту была выполнена двухэтапная реимплантация (ревизия, после заживления через 8 недель – повторная имплантация). Остеоинтеграция клинически и рентгенологически была достигнута через 12 недель. У двух пациентов (n=2) была отмечена трансдермальная миграция имплантата (продавливание части эндопротеза наружу) и последующее обнажение области накостного компонента с дальнейшей ревизией эндопротеза в одном случае. По нашему мнению, данное осложнение было связано с конструкционной особенностью имплантата. В дальнейшем было выполнено изменение дизайна данного типа имплантата.
Осложнения. Анализ
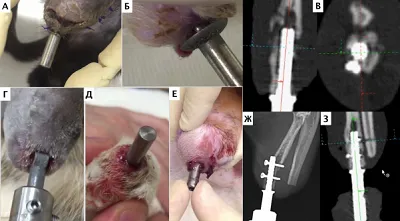 На основании всего периода наблюдения были выявлены следующие осложнения (Рис. 30): глубокая перипротезная инфекция (остеомиелит) (n=1), перипротезная трещина сегмента кости на этапе имплантации (n=2), дестабилизация эндопротеза в сочетании с перипротезной инфекцией (n=2); в одном случае выполнена полная ревизия эндопротеза, в другом — двухэтапная реимплантация (ревизионное протезирование через 6 недель), трансдермальная миграция имплантата (продавливание части эндопротеза наружу, n=3), ошибка позиционирования эндопротеза (n=2), мальпозиция блокировочных винтов (n=1), некроз кожи (n=3), секвестрация костной ткани перипротезной области в отдаленный период (n=1), резобрция — ремоделирование кости (n=1); перипротезный перелом в результате травматического фактора (застревание конечности) (n=1).
На основании всего периода наблюдения были выявлены следующие осложнения (Рис. 30): глубокая перипротезная инфекция (остеомиелит) (n=1), перипротезная трещина сегмента кости на этапе имплантации (n=2), дестабилизация эндопротеза в сочетании с перипротезной инфекцией (n=2); в одном случае выполнена полная ревизия эндопротеза, в другом — двухэтапная реимплантация (ревизионное протезирование через 6 недель), трансдермальная миграция имплантата (продавливание части эндопротеза наружу, n=3), ошибка позиционирования эндопротеза (n=2), мальпозиция блокировочных винтов (n=1), некроз кожи (n=3), секвестрация костной ткани перипротезной области в отдаленный период (n=1), резобрция — ремоделирование кости (n=1); перипротезный перелом в результате травматического фактора (застревание конечности) (n=1).
Для описания инфекционной группы осложнений, а именно имплантат-ассоциированной инфекции, использовали классификацию перипротезной инфекции после тотального эндопротезирования ТБС по Coventry-Fitzgerald-Tsukayama, основным критерием которой является время манифестации инфекции (временной интервал между операцией и первым проявлением инфекционного процесса) [22]. Острая послеоперационная инфекция (поверхностная перипротезная инфекция в ранний послеоперационный период) наблюдалась в 6 случаях, поздняя хроническая инфекция (от одного месяца до года) наблюдалась в 2 случаях, острая гематогенная (через год и более) наблюдалась в 1 случае. Стоит отметить, что на основании того, что сама методология ЧОП подразумевает прямой контакт имплантата с внешней средой, в клинической практике инфекционные осложнения рассматриваются не с точки зрения микробиологического исследования, а с точки зрения клинической значимости с проявлением симптомов гиперемии, отека мягких тканей, сопровождающихся снижением опороспособности, усилением хромоты.
Значимые же осложнения, которые потребовали выполнить демонтаж и полную ревизию протеза, были отмечены в 3-х случаях (3 протеза из 13 имплантируемых) и включали: нестабильность в раний период (3 недели) с сопутствующей глубокой перипротезной инфекцией (остеомиелит) (n=2), трансдермальную миграцию имплантата (n=2, в одном случае через 2 месяца была выполнена реимплантация). В первом случае неудовлетворительный результат мы связываем с несоответствием конструкционных особенностей имплантата (недостаточная механическая жесткость) и допуском к ранней активной нагрузке пациента.
Во втором случае была выполнена имплантация в предположительно инфицированную кость в связи с недостаточно адекватным уровнем резекции пораженного сегмента кости, не в пределах здоровых тканей. После проведения ревизионного протезирования и курса антибактериальной терапии через 6 недель была выполнена реимплантация эндопротеза. Период наблюдения на момент написания статьи — 3 месяца. Признаков нестабильности, инфицирование не выявлено.
В 3-м случае конструкционные особенности имплантата не соответствовали размеру пациента (кошка 1.9 кг с отсутствием мышечной ткани и подкожной жировой клетчатки в области культи). В результате позиционирования имплантата непосредственно под кожей, несмотря на стабильную функциональную опороспособность до самого демонтажа имплантата, произошла трансдермальная миграция эндопротеза с вторичным инфицированием. По нашему опыту пациенты с массой тела менее 2 кг с диаметром канала менее 3-х мм являются плохими кандидатами на имплантацию интрамедулярных вариантов протезов. Данным пациентам требуется разработка особого вида крепления, и на сегодняшний день данный вопрос остается открытым.
Стоит упомянуть о так называемом Стресс-Шилдинг синдроме (stress shielding), который представляет собой адаптационное ремоделирование кости и развивается как реакции костной ткани на длительное пребывание эндопротеза, который встречается как при бесцементном, так и при цементном эндопротезировании ТБС в гуманной и ветеринарной медицине. Данный синдром был отмечен нами у одного пациента после одномоментного двустороннего ЧОП голени. При денситометрической оценки с помощью КТ было отмечено уменьшение числовых значений коэфициента Хаунсфилда в проекции медиального кортикального слоя (перипротезная часть кости) большеберцовой кости (рис.26). Суть этого явления заключается в том, что после установки внутрикостного имплантата в проксимальный отдел бедренной кости (в случае тотального эндопротезирования ТБС) или, по нашим наблюдениям, область дистального сегмента конечностей, перипротезная часть кости выключается из нормальной нагрузки. Это связано с более высокой жесткостью металла относительно кости, в результате чего перипротезная кость менее нагружается за счет более проксимального ее распределения. Согласно закону Wolff происходит адаптивное ремоделирование костной ткани, что рентгенологически проявляется сочетанием резорбции кости в одних зонах, с гипертрофией — в других. Феномен стресс-шилдинга проявляется рентгенологически гипертрофией костной ткани у окончания ножки и формированием «пьедестала» наряду с резорбцией проксимальных отделов кости. Данный феномен в разной степени присущ как ножкам бесцементной, так и цементной фиксации. По ряду наблюдений в гуманной медицине такое явление нередко предшествует развитию нестабильности имплантата, является причиной развития болевого синдрома, а также вызывает трудности при выполнении ревизионного вмешательства [21]. Однако данных о развитии данного синдрома после ЧОП у животных на сегодняшний день не имеется. Таким образом, еще предстоит выявить критерии оценки резорбции костной ткани перипротезной области, оценить значимость, способы профилактики и отдаленные неблагоприятные последствия стресс-шилдинг синдрома в клинической практике ЧОП у животных.
Ограничения
На основании нашего опыта были сделаны выводы, что такая органосохранная процедура как ЧОП, может быть выполнена в тех случаях, когда предполагаемое улучшение качества жизни превышает возможные риски от самой процедуры. К таким случаям можно отнести ампутацию двух и более конечностей. Требуется выполнять прецизионную оценку кандидатов на данную хирургическую процедуру. Пациенты имеющие высокую ампутацию (по локтевой, коленный сустав) являются плохими кандидатами для данной хирургии, так как, несмотря на успешное достижение остеоинтеграции после процедуры ЧОП, не используют оперированную конечность в стато-локомоторном акте. По нашему мнению, это связано с удобством передвижения пациентов на 3-х здоровых конечностях, чем использование короткой культи конечности, даже в случае достижения остеоинтеграции, отсутствия болевого синдрома и при условии восстановления длины конечности путем « наращивания» внешнего протеза. Также неудовлетворительные результаты с отсутствием опоры на оперированную конечность возможны и у некоторых пациентов после ЧОП — преимущественно, одной конечности даже при условии низкой ампутации и после достижения результатов. Данный факт необходимо принимать во внимание при предоперационном информировании владельцев и также стремиться критично подходить к выбору кандидатов на ЧОП.
Обсуждение
Основным ограничением развития методики ЧОП и его последующего внедрения в широкую клиническую практику в ортопедии и онкохирургии, помимо традиционного скепсиса многих докторов, является «проблемная» перипротезная область контакта кожа-имплантат (протезно- кожный контакт). Общие осложнения данной области включают инфекцию, эпителиальную марсупиализацию (образование соединительнотканной муфты вокруг имплантата и формирование карманов) и миграцию эндопротеза (англ. permigration; постепенное выдавливание чрескожного имплантата, вторично по отношению к эпителиальной ткани), которые в конечном итоге могут привести к несостоятельности имплантации в целом [14, 16, 17]. Эти осложнения могут потребовать реоперации и последующего удаления имплантата с возможной резекцией сегментов пораженной конечности более проксимально [14]. Собаки представляют собой более сложных пациентов из-за вариабельности анатомии дистального сегмента конечностей, структуры костной ткани, общего размера пациентов и соответственно размеров конечности, неспособности обеспечить ограничение подвижности в период реабилитации и потенциальных проблем, связанных с реинфицированием.
Заключение
Таким образом, на сегодняшний день чрескожное остеоинтегрируемое протезирование (ЧОП) для животных является новейшей высокотехнологичной хирургической процедурой для сохранения функции конечности. Данный метод может быть использован в качестве альтернативы полной ампутации конечности при травматическом или неопластическом поражениях дистальных сегментов конечностей; также может быть альтернативной классической органосохранной хирургии при некоторых апендикулярных опухолях без ущерба для онкологического радикализма, а также при врожденных деформациях конечностей (эктродактилия, гемимелия).
Данный метод при соблюдении методологии оперативной техники, индивидуальном подборе-изготовлении имплантатов, а также использовании комбинированной модификации поверхностей имплантатов с созданием биопокрытий позволяет достигать высоких показателей приживаемости остеоинтегрируемых протезов с низким развитием инфекционных осложнений в отдаленный период и, как результат, добиваться более функциональных результатов в виде полноценной опороспособности в сравнении со стандартной ампутацией (на основании нашего опыта). По нашему мнению, несмотря на достаточно оптимистичные нынешние результаты протезирования (ЧОП) с использованием протезов SerGoFIX, для широкого внедрения метода в клиническую ортопедическую и онкохирургическую практику требуются дальнейшие исследования и отдаленная объективная оценка результатов через 24 и более месяцев с момента имплантации.
Список литературы
- Marks L.J., Michael J.W. Science, medicine, and the future: artificial limbs. BMJ. 2001; 323:732-735.
- Fitzpatrick N, Smith TJ, Pendegrass CJ, Yeadon R, Ring M, Goodship AE, Blunn GW. Intraosseous transcutaneous amputation prosthesis (ITAP) for limb salvage in 4 dogs.; Vet Surg. 2011 Dec;40(8):909-25. doi: 10.1111/j.1532-950X.2011.00891.x. Epub 2011 Nov.
- Withrow SJ, Hirsch VM: Owner response to amputation of a pet’s leg. Vet Med Small Anim Clin 1979;74:332–334.
- Kirpensteijn J, Van Den Bos R, Edenburg H: Adaption of dogs to the amputation of a limb and their owners satisfaction with the procedure. Vet Rec 1999;144:115– 118 5.
- National Canine Cancer Foundation, Scottsdale, AZ, USA. Available at http://www.wearethecure.org. Accessed October 25, 2011.
- Rutteman GR, Teske E: Chemotherapie bij dieren: ethisch of onethisch? Tijdschrift voor Diergeneeskunde 1997;122:78–79.
- Budsberg SC: Amputations, inOlmsteadML(ed): Small animal orthopedics. Philadelphia, PA, Saunders, 1995, pp 531–548.
- Kapp S. Suspension systems for prostheses. Clin. Orthop. Relat. Res. 1999; 361:55-62.
- Gallagher P., MacLachlan M. Adjustment to an artificial limb: a qualitative perspective. J. Health Psychol. 2001; 6:85-100.
- Hagberg K., Branemark P. Consequences of non- vascular trans-femoral amputation: a survey of quality of life, prosthetic use and problems. Prosthet. Orthot. Int. 2001; 25:186-194.
- Hobday FTG: ChapterXXII,thelimbsandtail,in Surgical diseases of the dog and cat (ed 2). London, Bailliere, Tindall and Cox, 1906, pp 343–346.
- PHILLIPS A, KULENDRA E., BISHOP E.,: Clinical outcome and complications of thoracic and pelvic limb stump and socket prostheses; Journal of Small Animal Practice. 57():49–50, May 2016.
- Branemark P.I., Hansson B.O., Adell R., Breine U., Lindström J., Hallen O., Öhman A. Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period. Scand. J. Plast. Reconstr. Suppl. 1977; 16: 1-132.
- Pendegrass CJ: Development of a soft tissue seal around bone-anchored transcutaneous amputation prostheses. Biomaterials 27:4183–4191, 2006.
- Hagberg K., Branemark R., Gunterberg B., Rydevik B. Osseointegrated transfemoral amputation prostheses: prospective results of general and conditionspecific quality of life in 18 patients at 2-year follow-up. Prosthet. Orthot. Int. 2008; 32:29-41.
- Drygas K.A, Taylor R, Sidebotham C.G, Hugate R.R, McAlexander H.: Transcutaneous Tibial Implants: A Surgical Procedure for Restoring Ambulation After Amputation of the Distal Aspect of the Tibia in a Dog; Veterinary Surgery 37:322–327, 2008.
- Middleton CA, Pendegrass CJ, Gordon G, et al: Fibronectin silanized titanium alloy: a bioinductive and durable coating to enhance fibroblast attachment in vitro. J Biomed Mater Res Part A, Epub ahead of print. PMID: 17584893. 2007.
- Иттиев Э.Б., Маркин В.А. Влиянием трансдентального стоечного имплантата на ткани челюсти и зуба. // Материалы I Международной конференции; "Современные аспекты реабилитации в медицине" - Ереван- 2003 — стр.157- 158.
- Jeyapalina S.,Beck J.P., Bachus K.N., at al.: Radiographic Evaluation of Bone Adaptation Adjacent to Percutaneous Osseointegrated Prostheses in a Sheep Model; Clin Orthop Relat Res. 2014 Oct; 472(10): 2966–2977., Published 2014 Feb 21.
- Gruen T. A., Gregory M. S., McNeice M. et al.: Retrospective sequential radiographic evaluation of 350 con- secutive patients with 454 cemented femoral stems designed for the identification and classification of their modes offailure / // Clin. Orthop. Relat. Res. — 1979. — Vol. 141. — P. 17–27.
- Филиппенко В. А., Подгайская О.А., Танькут А. В.: Ремоделирование костной ткани перипротезной зоны в зависимости от типа фиксации ножки эндопротеза и формы канала бедренной кости; Ортопедия, травматология и протезирование. 2013. No 4: 77–81.
- Al Muderis M1,2,3, Lu W4, Li JJ5.: Osseointegrated Prosthetic Limb for the treatment of lower limb amputations : Experience and outcomes.; Unfallchirurg. 2017 Apr;120(4):306-311. doi: 10.1007/s00113-016-0296-8.
- Интернет ресурс: https://www.prostheticbody.com/percutaneousosseointegrated-prostheses-for-amputees/
- Shevtsov M. A.,Galibin О.V., Yudintceva N.M: Two-stage implantation of the skin and bone integrated pylon (SBIP) seeded with autologous fibroblasts induced into osteoblast differentiation for direct skeletal attachment of limb prostheses; J Biomed Mater Res A. Author manuscript; 2014 Sep; 102(9): 3033–3048.